Quand une transgression du code permet la vie et guérit peut-être de la mucoviscidose
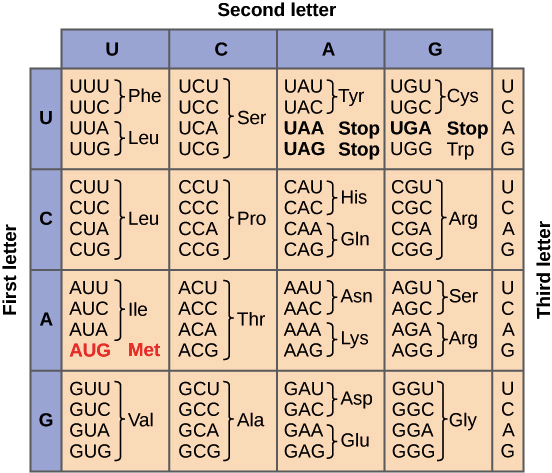
Dans nos ouvrages de référence le code génétique est présenté comme universel, et les 3 codons UAA, UAG,UGA comme « Stop », signifiant la fin de la traduction. Dans le vivant il y a toujours des exceptions, et plusieurs organismes – surtout des génomes mitochondriaux et bactériens – fonctionnent avec un code génétique quelque peu différent. Un trypanosomatide (Blastocrithidia nonstop sp. nov), avait été prédit in silico pour réaffecter les trois codons d’arrêt en tant que codons sens. Récemment, Kachale,&.al.(2023) ici ont réussi à montrer comment chez ce protistes le codon stop UGA était réaffecté au glutamate. Ils montrent que le gène de cet ARNt, modifié, conduit à un raccourcissement de la tige de l’anticodon (AS) de l’ARNtTrp (cf. figure 2) et une modification du facteur de libération (eRF1). ![]() encourage le lecteur à aller vérifier dans l’article d’origine :ici
encourage le lecteur à aller vérifier dans l’article d’origine :ici
Fig 1: il vaut la peine de lire en détail la page de titre [img]. Source :Nature, Cover, (2023) Kelly Krause/Nature; Cover concept: Leoš Shivaya Valášek
La page joue sur les mots : Stops making sense est intraduisible directement. La phrase signifie à la fois « des stops qui fond du sens » et « cesser d’avoir du sens ».
D’où la traduction très libre dans le titre de JTS : Brûler un codon stop permet la vie de certains organismes
Lorsque les gènes sont lus par les ribosomes, les codons d’arrêt agissent comme ponctuation, indiquant au ribosome quand arrêter la synthèse des protéines. Mais chez certains protozoaires, les séquences de bases qui composent les codons d’arrêt peuvent également coder des acides aminés, selon l’endroit où le codon apparaît dans l’ARN messager. Kachale,(2023) et ses collègues révèlent comment ces organismes reconnaissent quand les codons doivent être lus comme un codon et quand ils sont un ordre d’arrêt. Les chercheurs se sont concentrés sur un parasite unicellulaire précédemment non décrit appelé Blastocrithidia nonstop. Ils ont découvert qu’il présentait des changements fondamentaux associés aux molécules d’ARN de transfert qui permettent au ribosome de lire les codons d’arrêt en tant qu’acides aminés et de produire ainsi des protéines de pleine longueur. Traduction de (Kachale,&.al.,2023) ![]() encourage le lecteur à aller vérifier dans l’article d’origine : ici
encourage le lecteur à aller vérifier dans l’article d’origine : ici
Fig 2: b)Structures secondaires schématiques pour tRNAsGlu reconnaissant tous les codons du glutamate. [img]. Source :Kachale,&.al., (2023)
« Le code génétique standard contient 64 codons, dont 61 codent pour des acides aminés et trois définissent des codons stop, signifiant la fin de la traduction. À ce jour, au moins 30 altérations différentes du code génétique sont connues, dont la plupart sont confinées aux génomes mitochondrial et bactérien. [Parfois c’est le codon stop qui est réaffecté à un acide aminé…] Les organismes où l’on trouve des réaffectations de codons stop sont très divers et les plus fréquents sont sont parmi les ciliés où l’on trouve plusieurs codes génétiques alternatifs. « Traduction de (Kachale,&.al.,2023) ![]() encourage le lecteur à aller vérifier dans l’article d’origine : ici
encourage le lecteur à aller vérifier dans l’article d’origine : ici
Un cas classique de maladie génétique à l’école : un espoir de traitement assez étonnant.
JTS propose à ses lecteurs un autre article (Leroy, et al. (2023) ici où un extrait de champignon outrepasse un codon stop résultant d’une mutation non-sens (delF508) bien avant la fin du gène, et il n’y a pas de protéine CFTR. Cela ouvre l’espoir de guérir la forme la plus fréquente (70%–80% des cas) de Mucoviscidose. Selon les auteurs ça ne semble pas avoir d’effets toxiques, du moins à ce stade des recherches. ![]() ici
ici
Fig 3: a)Phylogénie de Blastocrithidia-nonstop, d) les codons reaffectés Blastocrithidia-nonstop. [img]. Source :Kachale,&.al., (2023)
« Les protistes kinétoplastidés tels que les trypanosomes, les leishmanies et les phytomonades sont responsables de maladies des insectes, des plantes et des vertébrés, y compris les humains[…] Ici, nous avons identifié un mécanisme moléculaire jusqu’alors inconnu de la réaffectation de l’UGA chez B. nonstop sp. nov. Il combine un raccourcissement de la tige de l’anticodon (AS) de l’ARNtTrp avec une altération spécifique du facteur de libération eucaryote 1 (eRF1), conduisant à la robustesse de cette réaffectation, un prérequis facilitant probablement cette réaffectation (r)évolutionnaire. »
Traduction de (Kachale,&.al.,2023) ![]() encourage le lecteur à aller vérifier dans l’article d’origine : ici
encourage le lecteur à aller vérifier dans l’article d’origine : ici
La mucoviscidose…?
« Malgré de récentes avancées thérapeutiques, les personnes atteintes de mucoviscidose — une naissance sur 2500 en Europe — ont une espérance de vie qui ne dépasse pas 46 ans et une qualité de vie très impactée. La maladie est due à une ou plusieurs mutations du gène CFTR, qui affecte le bon fonctionnement d’une barrière protectrice essentielle. » UNIGE,Communiqués de presse, (2022, mai 24) ![]() encourage le lecteur à aller vérifier dans l’article d’origine : ici
encourage le lecteur à aller vérifier dans l’article d’origine : ici
Une transgression du code guérit peut-être de la mucoviscidose
La mucoviscidose (Cystic Fibrosis en anglais) est la maladie rare la plus fréquente (sic), avec environ 1 cas pour 3 000 naissances en Europe et aux États-Unis. Cette pathologie autosomique récessive est liée à un dysfonctionnement ou à l’absence de la protéine (CFTR), un canal transportant les ions chlorure du milieu intracellulaire vers le milieu extracellulaire. Cette protéine membranaire est principalement exprimée par les cellules épithéliales et régule la production de mucus. Environ 2 000 mutations ont été identifiées dans la mucoviscidose, y compris delF508 dans près de 70 à 80 % des cas de mucoviscidose (www.orpha.net). Heureusement, pour cette mutation en particulier, des traitements existent. […]Mais environ 10 % des patients atteints de mucoviscidose sont porteurs de mutations qui entraînent des mutations non-sens résultant en l’absence de protéine CFTR et qui ne répondent pas à ces traitements. […] Plus préciséement, la présence d’une mutation non-sens entraîne de faibles niveaux d’expression de l’ARNm mutant, en raison du nonsense-mediated mRNA decay(NMD), un mécanisme de surveillance de l’ARNm qui dégrade les ARNm avec un codon de terminaison prématuré (PTC). Traduction de Leroy, et al. (2023) ![]() encourage le lecteur à aller vérifier dans l’article d’origine : ici
encourage le lecteur à aller vérifier dans l’article d’origine : ici
En explorant de très nombreuses molécules à la recherche d’effets cliniques possibles, Leroy, et al. (2023) ici ont repéré la 2,6-diaminopurine (DAP). Elle « a été purifiée à partir du champignon Lepista flaccida. DAP masque la mutation non-sens et efface ses conséquences, ce qui permet de restaurer une protéine à la bonne taille et fonctionnelle, en tout cas dans les modèles que nous avons testés », explique Fabrice Lejeune de l’INSERM, un des auteurs de l’étude au micro de Sarah Dirren CQFD (2023) ![]() encourage le lecteur à aller vérifier dans l’émission d’origine : ici
encourage le lecteur à aller vérifier dans l’émission d’origine : ici
La molécule DAP a été testée chez des souris, sur le gène CFTR responsable de la mucoviscidose: « On a obtenu une restauration fonctionnelle de ce canal CFTR en donnant à ces souris, tous les jours, oralement, la DAP. On l’a aussi testée sur des cellules de patients atteints de mucoviscidose et sur des organoïdes, soit des cellules qui s’assemblent pour mimer les caractéristiques d’un organe. Et, chaque fois, nous avons obtenu une restauration de l’expression du canal CFTR, mais aussi une restauration fonctionnelle de celui-ci », souligne Fabrice Lejeune. In Dirren, Sarah CQFD (2023) ![]() encourage le lecteur à aller vérifier dans l’émission d’origine : ici
encourage le lecteur à aller vérifier dans l’émission d’origine : ici
« Dans cette étude, nous montrons que la DAP peut corriger une mutation non-sens du gène CFTR in vivo dans un nouveau modèle de souris à mucoviscidose, in utero, et par l’allaitement, grâce notamment à des propriétés pharmacocinétiques adéquates. La DAP s’avère très stable dans le plasma et est distribuée dans tout l’organisme. La capacité de la DAP à corriger diverses mutations non-sens UGA endogènes du gène CFTR et à restaurer sa fonction chez la souris, dans les organoïdes dérivés de cellules murines ou de patients, et dans les cellules de patients atteints de mucoviscidose révèle le potentiel de telles molécules stimulant la lecture dans développer une approche thérapeutique. Le fait que la correction par DAP de certaines mutations non-sens atteigne un niveau cliniquement pertinent, à en juger par des études antérieures, rend l’utilisation de ce composé d’autant plus attractive. »Traduction de Leroy, et al. (2023) ![]() encourage le lecteur à aller vérifier dans l’article d’origine : ici
encourage le lecteur à aller vérifier dans l’article d’origine : ici
Des activités?
- Permettre aux élèves de trouver le gène CFTR dans le génome humain
- Permettre aux élèves de vérifier eux-mêmes où on trouve des changements d’une seule base dans le gène CFTR
- Explorer comment un SNP (mutation ∂F508) est la cause la plus fréquente de mucoviscidose)
- Atelier découverte de la bioinformatique pour les plus jeunes
- Imprimer en 3D la protéine CFTR
Une section « Outlook » sur la mucoviscidose dans Nature

De nouvelles thérapies transforment la mucoviscidose (fibrose kystique), une maladie héréditaire qui provoque de graves accumulation de mucus, d’infection et d’inflammation, en une affection plus gérable avec laquelle les gens peuvent survivre jusqu’à l’âge adulte.
- Nature, Outlook (2020, juillet 29). Cystic fibrosis. Nature. https://www.nature.com/collections/badbgijdjb
Mucoviscidose: restaurer l’intégrité des voies respiratoires
« La mucoviscidose est une maladie génétique rare aux symptômes souvent très graves. Les malades souffrent notamment d’infections bactériennes chroniques pouvant évoluer vers une insuffisance respiratoire. En cause, des mutations du gène CFTR, dont le rôle est de réguler les mouvements d’eau à travers la membrane cellulaire. La qualité du mucus s’en trouve modifiée et il n’est alors plus capable de capturer les bactéries indésirables et de les expulser. » UNIGE, Communiqués de presse, (2022, mai 24) Jump-To-Science : donner envie d’accéder aux articles plutôt que vulgariser encourage le lecteur à aller vérifier dans l’article d’origine : ici
Une équipe du professeur Chanson à l’UNIGE révèle récemment qu’hydrater la surface des voies respiratoires des personnes atteintes de mucoviscidose restaure leur barrière de protection contre les bactéries indésirables. Simonin,& al. (2022) Jump-To-Science : donner envie d’accéder aux articles plutôt que vulgariser ![]() encourage le lecteur à aller vérifier dans l’article d’origine : ici.
encourage le lecteur à aller vérifier dans l’article d’origine : ici.
Références:
- Dirren, S. (Journaliste). (2023, janvier 30). Un champignon pourrait lutter contre la mucoviscidose, selon une étude. In CQFD, RTS. https://www.rts.ch/info/sciences-tech/medecine/13743516-un-champignon-pourrait-lutter-contre-la-mucoviscidose-selon-une-etude.html
- Kachale, A., Pavlíková, Z., Nenarokova, A., Roithová, A., Durante, I. M., Miletínová, P., Záhonová, K., Nenarokov, S., Votýpka, J., Horáková, E., Ross, R. L., Yurchenko, V., Beznosková, P., Paris, Z., Valášek, L. S., & Lukeš, J. (2023). Short tRNA anticodon stem and mutant eRF1 allow stop codon reassignment.Nature, 613(7945), Art. 7945. https://doi.org/10.1038/s41586-022-05584-2
- Leroy, C., Spelier, S., Essonghe, N. C., Poix, V., Kong, R., Gizzi, P., Bourban, C., Amand, S., Bailly, C., Guilbert, R., Hannebique, D., Persoons, P., Arhant, G., Prévotat, A., Reix, P., Hubert, D., Gérardin, M., Chamaillard, M., Prevarskaya, N., … Lejeune, F. (2023). Use of 2,6-diaminopurine as a potent suppressor of UGA premature stop codons in cystic fibrosis. Molecular Therapy, S152500162300014X. https://doi.org/10.1016/j.ymthe.2023.01.014
- Nature, editor, (2023). Stops making sense. (2023, janvier 24). Nature. Title page comment. https://www.nature.com/nature/volumes/613/issues/7945
- Nature, Outlook (2020, juillet 29). Cystic fibrosis. Nature. https://www.nature.com/collections/badbgijdjb
- Simonin, J. L., Luscher, A., Losa, D., Badaoui, M., van Delden, C., Köhler, T., & Chanson, M. (2022). Surface Hydration Protects Cystic Fibrosis Airways from Infection by Restoring Junctional Networks. Cells, 11(9), Art. 9.https://doi.org/10.3390/cells11091587
- UNIGE,Communiqués de presse, (2022, mai 24). Mucoviscidose : Restaurer l’intégrité des voies respiratoires – https://www.unige.ch/communication/communiques/2022/mucoviscidose-restaurer-lintegrite-des-voies-respiratoires


