CRISPR bouleverse la biologie ; Gene-Drive le gène superdominant qui s’impose dans un écosystème ?
En très peu de temps les technologies issues de la découverte du mécanisme de modification génique CRISPR/Cas-9 ont profondément modifié le champ des possibles en ingénierie du vivant.
Découvert chez les bactéries dans l’industrie laitière au Danemark en 2007, ce mécanisme ouvre probablement autant de potentiels que la PCR.
Il doit une bonne part de son succès à sa structure modulaire. Il combine a) une séquence d’ARN qui assure la reconnaissance d’un site spécifique sur l’ADN, b) un site enzymatique qui peut couper ou modifier l’ADN positionné par l’ARN à un endroit bien défini. Les combinaisons d’ARN spécifique et modifications notamment de l’action enzymatique que cela permet sont presque infinies. Cette façon modulaire correspond bien à une conception de la biologie qu’on appelle aussi ingénierie du vivant. Les applications sont innombrables et les enjeux immenses … et parfois inquiétants. Nous décrirons ici notamment un système récemment découvert appelé Gene-Drive qui assure une transmission forcée d’un allèle – une exception aux lois de Mendel en somme. Et peut-être ce que nos élèves comprennent quand on leur parle de dominance. Très puissant, ce système Gene-Drive pose des questions importantes et certains scientifiques élèvent la voix pour demander un temps de réflexion alors que d’autres (du côté de l’industrie je présume) cherchent plutôt à avancer vite et poser leurs pions dans ce qui pourrait être un marché très très lucratif.
Ce système pourrait avoir des applications en écologie pour lutter contre des parasites ou des maladies et ouvre des potentiels fascinants… mais inquiète certains scientifiques. Nous évoquerons une mise en perspective évolutive et dans la dynamiques des écosystèmes.
Apéritif->Tremplin plutôt que Review
Cette publication vise à repérer dans l’immensité des recherches des domaines ou la biologie change et stimuler l’envie de lire – et en faciliter au lecteur l’accès aux – textes d’origine. C’est plutôt un apéritif, et un tremplin vers… qu’un review.
Pour approfondir ?
Un dossier spécial de Nature permettra au lecteur d’approfondir ce qui est présenté ici.
- Nature special: CRISPR — the good, the bad and the unknown (Les membres Expériment@l peuvent obtenir cet aricle)
 Fig 1 à droite : Un dossier de Nature sur CRISPR/Cas9 intitulé « CRISPR the good, the bad and the unknown » [img] source : K.C. Roeyer
Fig 1 à droite : Un dossier de Nature sur CRISPR/Cas9 intitulé « CRISPR the good, the bad and the unknown » [img] source : K.C. Roeyer
On y trouve notamment d’un article de Heidi Ledford (ici ).
Nous proposons ici quelques éléments sur le mécanisme, évoquerons les potentiels et ébaucherons une réflexion sur les enjeux.
Le mécanisme
Le mécanisme CRISPR / CAS9 a été décrit dans une bio-tremplins (CRISPR – le couteau suisse génétique ?18 septembre 2013 ). Et dans Pennisi, E. (2013). doi:10.1126/science.341.6148.833 (Les membres Expériment@l peuvent obtenir cet aricle)

Fig 2 : Le mécanisme d’action de CRISPR est simple et modulaire . Cliquer pour agrandir. Il est développé plus bas [img] source : Pennisi (2013)
Une très belle vidéo du MIT en montre bien la dynamique :
- Video: Genome Editing with CRISPR-Cas9 (source McGovern Institute for Brain Research at MIT)
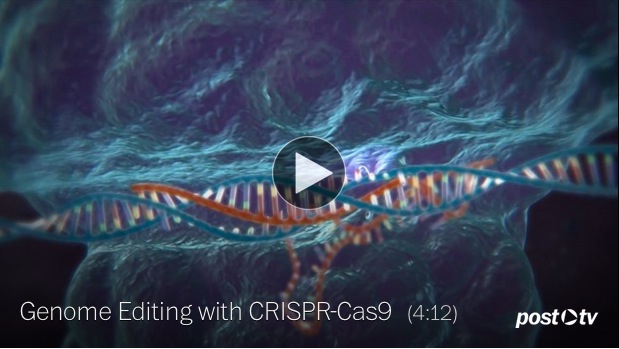
Fig 3 : Le mécanisme d’action de CRISPR-Cas9 (img video)(Feng Zhang/McGovern Institute for Brain Research/MIT)
Les potentiels
Ce que cette technique rend possible n’a pas fini d’être exploré, mais Heidi Ledford (2015) cite plusieurs potentiels :
- La possibilité de développer en quelques semaines – plutôt que des années, et mieux ciblés – des modèles permettant d’étudier des maladies.
- En avril des chercheurs ont annoncé avoir utilisé CRISPR pour modifier des embryons humains
- Liang, P., Xu, Y., et al . Protein & Cell, 6(5),) News Nature: Cyranoski, D., & Reardon, S. (2015) ici
- Accélérer la production d’organismes transgéniques (souris, drososphiles, Candida albicans, etc) permettant d’étudier des maladies ou des mécanismes biologiques
- Réparer de manière ciblée le défaut génétique causant une maladie (pour le moment en test chez la souris pour la Tyrosinaemie. Et à terme les cellules souches sanguines pour corriger l’anémie falciforme ou la ß-thalassémie.
- La précision du ciblage de la modification semble être une point fort de CRISPR, cependant E. Pennisi cite Keith Joung qui a observé des mutation hors cible à une fréquence de 0.1% à plus de 60%.
- Améliorer le ciblage des modifications génétiques dans les plantes cultivées et le bétail – l’insertion aléatoire du transgène a toujours été une grosse critique des mécanismes traditionnels d’insertion de gènes dans les OGM.
- Cyranoski, D. (2015). Super-muscly pigs created by small genetic tweak. Nature News, 523(7558), 13. http://doi.org/10.1038/523013a (Les membres Expériment@l peuvent obtenir cet aricle)
- Le coût réduit pourrait permettre de modifier génétiquement des cultures plus rares que le blé ou le maïs.
- La précision du remplacement d’un gène rendrait difficile voire impossible d’identifier les plantes génétiquement modifiées. (Jennifer Kuzma dit : “It will be hard to detect whether something has been mutated conventionally or genetically engineered.”)
- C’est à la fois un problème potentiel (on ne pourrait vérifier si un organisme est modifié génétiquement) , et une solution potentielle (si un ADN est identique à la version « naturelle » comment peut-il avoir d’autres effets ?)
- C’est à la fois un problème potentiel (on ne pourrait vérifier si un organisme est modifié génétiquement) , et une solution potentielle (si un ADN est identique à la version « naturelle » comment peut-il avoir d’autres effets ?)
- Modifications écologiques :
- Intervenir massivement dans la composition génétique d’une population pourrait devenir possible avec une technique Gene-Drive qui cause la copie d’un allèle produit par CRISPR sur l’autre chromosome assurant que les deux chromosomes reçoivent la version mutée. – Une sorte de transmission forcée de cet allèle : une réaction en chaîne qui répandrait cet allèle très rapidement dans toute la population.
Ce dernier potentiel repose sur un mécanisme particulier. Revenons sur cette technique.
Gene-Drive, l’allèle super-dominant : une réaction en chaîne rend possible une modification forcée de l’autre gamète ?
Habituellement un changement génétique prend longtemps pour se répandre dans la population, car une seule copie du gène muté est transmis à chaque fécondation et donc seule la moitié des descendants reçoit la copie mutée.
Mais Gene-Drive assure que la mutation produite par CRISPR sur un chromosome se recopie sur le chromosome homologue à chaque génération, assurant que presque tous les descendants de l’individu muté portent la mutation. La mutation se répand alors exponentiellement dans la population comme une sorte de réaction en chaine.
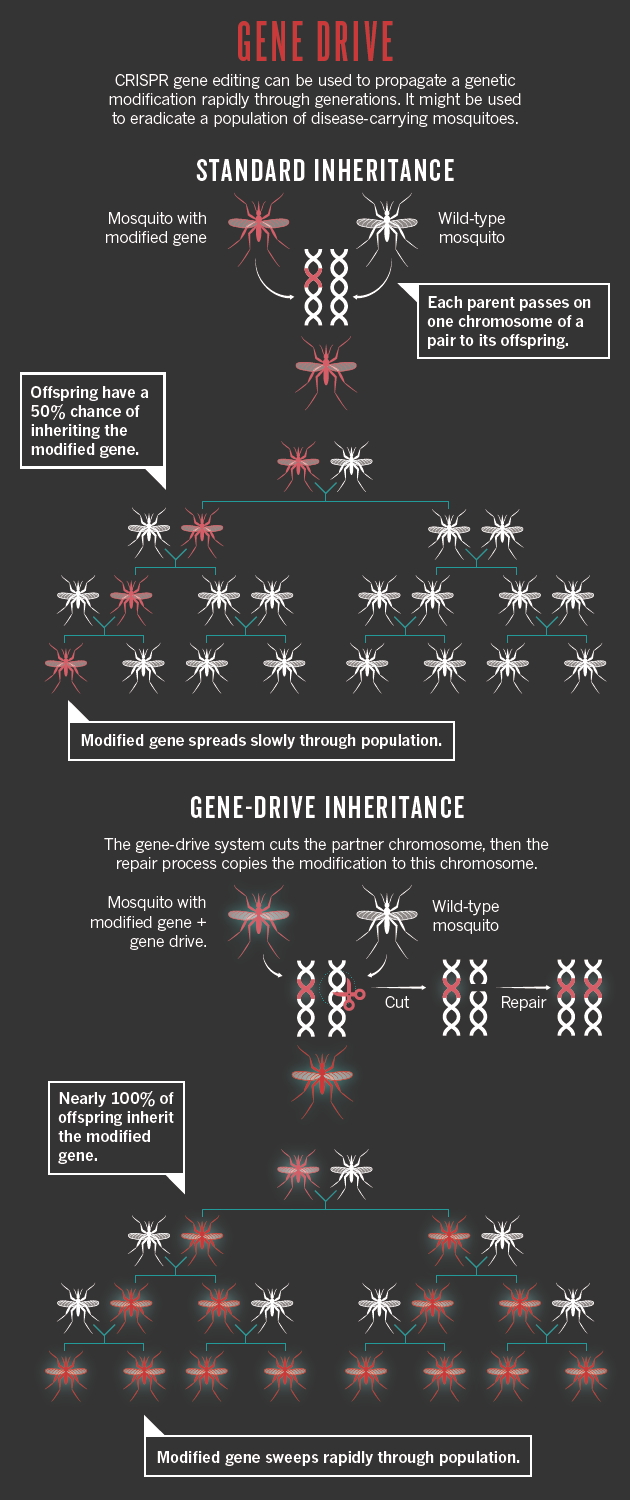
Fig. 4: Gene Drive assure une sorte de transmission forcée de l’allèle muté. [img] source Scopus; Patents: The Lens; Funding: NIH RePORTER.
Une réaction en chaine pour convertir une mutation hetrozygote en homozygote !
Dans un article récent Gantz, V. M., & Bier, E. (2015) (Les membres Expériment@l peuvent obtenir cet aricle) intitulé The mutagenic chain reaction: A method for converting heterozygous to homozygous mutations (ici) décrivent le mécanisme de Gene-drive : On prépare et insère un plasmide portant le transgène Cas9, un ARN (gRNA) qui cible la séquence d’intérêt et des bras homologues flanquant le site à cliver (cf fig.5 ). Ensuite le mécanisme de réparation homologue dirigée (HDR) insère cette cassette sur un des chromosomes. Alors la cassette Cas9-gRNA sur le chromosome modifié exprime la protéine Cas9 et le gRNA qui cible le site de coupure. une fois cet ADN coupé, le mécanisme de réparation homologue dirigée (HDR) insère la cassette sur l’autre chromosome. Ainsi le gène est transféré sur le chromosome homologue !
![1 Scheme outlining the mutagenic chain reaction (MCR).,,(A to C) A plasmid consisting of a core cassette carrying a Cas9 transgene, a gRNA targeting a genomic sequence of interest, and flanking homology arms corresponding to genomic sequences abutting the target cleavage site (A) inserts the core Cas9-gRNA cassette into the targeted locus via HDR [(B) and (C)]. (D to F) In turn, the inserted cassette expresses both Cas9 and the gRNA, leading to cleavage (D) and HDR-mediated insertion of the cassette into the second allele, thereby rendering the mutation homozygous [(E) and (F)]. HA1 and HA2 denote the two homology](http://www.sciencemag.org/content/348/6233/442/F1.medium.gif)
Fig 5 : Le mécanisme de Gene-drive : A) un plasmide portant le transgène Cas9, un ARN (gRNA) qui cible la séquence d’intérêt et des bras homologues flanquant le site à cliver (HA1 et HA2). B) et C) le mécanisme de réparation homologue dirigée (HDR) insère alors la cassette sur un des chromosomes. D) la cassette Cas9-gRNA sur le chromosome modifié exprime la protéine Cas9 et le gRNA qui cible le site de coupure. Ensuite E) et F), le mécanisme de réparation homologue dirigée (HDR) insère la cassette sur l’autre chromosomes [img] source Gantz, V. M., & Bier, E. (2015).
Gene-Drive le gène qui s’impose – ou ce que les élèves imaginent en étudiant Mendel ?
Gene-Drive est une exception ( de plus…) au modèle de Mendel … L’examen d’un tableau des zygotes produits (tableau de Punett) avec Gene-Drive peut être une manière de discuter- par contraste – les effets du modèle mendélien lois en distinguant le cas Gene-Drive du cas normal.
On pourrait produire un tableau de Punett d’un croisement monohybride avec dominance simple et le même avec Gene-Drive sur l’allèle récessif ou sur l’allèle dominant ?
| Modèle Mendélien | Gris | blanc |
| Gris | GG | Gb |
| blanc | Gb | bb |
cela pourrait donner par exemple avec Gene-Drive
| Avec l’allèle b muni de Gene-Drive = -gd |
Gris | blanc-gd |
| Gris | GG | bb |
| blanc-gd | bb | bb |
En effet de nombreux élèves semblent – dans mon expérience – imaginer que les allèles dominants s’imposent lors d’une fécondation erronée par rapport à Mendel, leur conception naïve préfigure assez bien Gene-Drive ! Les faire comparer ce qui se passe avec Gene-Drive et la classique ségrégation mendélienne pourrait aider à révéler leur modèle naïf et peut-être le dépasser ?
Quelques enjeux
Chacun de ces potentiels peut être réalisé pour le meilleur (soigner, diagnostiquer, comprendre et mieux traiter, …) mais aussi le pire (des OGM indétectables, des modifications géniques qui ne touchent que les personnes munies d’une certaine particularité génétique, diffusion impossibles à contrôler de gènes dangereux, et je suis sûr que certains esprits tordus ont imaginé bien pire !).
Par exemple la modification d’embryons humains avec CRISPR (Liang, et al., 2015) (Les membres Expériment@l peuvent obtenir cet aricle) qui pourrait conduire à une forme de renouveau eugénique (risques de voir apparaitre des ‘designer babies’) est discuté par certains médias http://www.bbc.com/news/health-30742774 mais pourrait permettre de guérir des maladies génétiques comme la l’anémie falciforme ou la ß-thalassémie.
Ainsi s’oppose le devoir moral de poursuivre des recherches qui pourraient faire le bien et l’urgence tout aussi morale de s’abstenir de recherches potentiellement risquées. Comment aborder ces questions vives en classe ?
Techniques – potentiels – enjeux
Clarifier les techniques, explorer les potentiels, problématiser en termes d’enjeux – de valeurs qui s’opposent – peut être une façon de discuter en classe des questions vives que la science soulève
Cette tension entre les effets négatifs de (se priver de bienfait potentiels) et les effets positifs (éviter les méfaits) d’une nouvelle technique est au coeur d’un débat sur le rôle de la Bio-Ethique que Steven Pinker de Harvard a relancé dans un article opinion piece The moral imperative for bioethics dans The Boston Globe.
Pinker argumente qu’une excessive focalisation sur les possibles effets négatifs cause des délais qui cause des souffrances inutiles en privant des patients de de traitements
« In his article, Pinker wrote that delays caused by bioethical regulations can lead to loss of life because potential treatments are withheld from patients. He added that the future of biotechnologies is so difficult to accurately predict that policies based on these predictions will not effectively reduce risk. “The primary moral goal for today’s bioethics can be summarized in a single sentence. Get out of the way.”
Cette position très controversée pourrait être une amorce pour lancer un débat en classe : problématiser en recherchant les potentiels puis en peser les bénéfices (raisons de réaliser ce potentiel) contre les risques (raisons de s’abstenir de cette technique) pour les discuter en termes d’opposition de valeurs morales ( Exemple).
Quelques réflexions sur la construction d’une opinion.
Savoir ou opinion ?L’opinion » n’est pas de même nature que le savoir. La question essentielle n’est alors plus de trancher entre points de vue exprimés pour savoir qui a raison et qui a tort. C’est d’accéder aux raisons profondes qui justifient les points de vue en présence. » (Astolfi, 2008) |
Un des objectifs fondamentaux assigné aux sciences dans le PER est d’aider les élèves – futurs citoyens – à comprendre, décider et agir sur le monde.
Ainsi les aider à se construire une opinion sur des questions vives de notre temps fait partie de la mission des enseignants de science.
On peut par exemple situer la construction d’une opinion dans une approche en trois étapes : 1) comprendre les techniques, 2) explorer les potentiels et 3) discuter les enjeux.
Revenir à une solide connaissance des mécanismes
Bien comprendre les potentiels (puis les enjeux) nécessite – et peut motiver les élèves à développer – une solide connaissance des techniques et mécanismes biologiques. Une première discussion peut conduire à identifier des mécanismes biologiques et des techniques qu’on pourra ensuite clarifier ou approfondir avec les élèves.
Par exemple dans le débat sur les test génétiques, mettre en évidence la confusion entre empreinte ADN (employé dans la médecine légale : et reposant sur la RFLP ) et séquençage permet de distinguer des potentiels ( l’empreinte ne permet pas de connaitre les caractéristiques génétiques telles que la susceptibilité à une maladie,…) Parler de « test ADN » qui intéresserait un employeur ou un assureur lorsqu’il s’agit d’empreinte ADN c’est construire un débat sur du sable.
Après avoir vu les mécanisme de Gene-Drive quelques réflexions sur les potentiels
Gene-Drive, la menace des écosystèmes
Habituellement un changement génétique prend longtemps pour se répandre dans la population, car une seule copie du gène muté est transmis à chaque fécondation et donc seule la moitié des descendants reçoit la copie mutée. une sorte de réaction en chaîne : Gantz, V. M., et al (2015). The mutagenic chain reaction: A method for converting heterozygous to homozygous mutations.(ici).
Heidi Ledford indique qu’une modification introduite dans un moustique pourrait atteindre toute la population en une saison. Et si cette mutation réduit le nombre de descendants, la population de moustiques pourrait être éliminée et les parasites (malaria) qu’ils portent éliminés aussi !
Dans un éditorial, intitulé Driving test (ici) (Les membres Expériment@l peuvent obtenir cet aricle), l’éditeur de Nature discute ces risques.
Une perspective Evolutionniste
On pourrait tenter de mettre en perspective l’angoisse que ces potentiels pourraient susciter. en discutant la plausibilité de ces potentiels extrèmes.
Je m’interroge – dans la perspective évolutionniste qui est celle du biologiste – sur ce potentiel de dissémination incontrôlée aux effets extrêmement perturbateurs. Si un spécialiste peut compléter commenter nuancer le blog pourra mettre à disposition de tous la discussion.
Sans diminuer le mérite des chercheurs qui ont identifié CRISPR et Gene-Drive, il me semble que nous devons avoir l’humilité de reconnaitre que ces mécanismes existent sans doute bien avant l’homme; qu’ils ont donc dû produire tous ces effets que nous imaginons et sans doute bien d’autres.
Les traces de telles dévastations ne devraient elles pas se trouver dans les génomes ?
Dans quelle mesure les effets de Gene-Drive seraient-ils comparables aux transposons, séquences virales intégrées et autres Alu dont notre ADN est bombardé au cours de l’évolution ?
Notre ADN contient en effet 8% de séquences d’origine virale (Dolei, A., & al. 2015), 10 % de séquences répétées Alu (Les séquences Alu sont des séquences ADN (de 200 à 300 pb) qui sont insérées un peu partout dans le génome humain et qui sont susceptibles de se déplacer (transposables) (de la famille des short interspersed elements (SINEs) en anglais)) et bien d’autres types de séquences – contre seulement 1.5% de gènes codant pour des protéines (Bio-Tremplins 1 mai 2011 Notre ADN est-il naturel ? (suite) )
« Human DNA contains a large amount of « alien » material, since an average of 8% of all our DNA is of retroviral origin « Dolei, A., & al. (2015)
Ainsi les ADN de tous les organismes – dont les humains – sont confrontés à de nombreux apports d’ADN qui se multiplient, se déplacent d’un endroit à l’autre entre espèces et à l’intérieur de notre ADN … Gene-Drive est-il un parmi beaucoup d’autres mécanismes produisant la biodiversité génétique dont nous sommes une expression. Que des spécialistes me contredisent ou complètent cette mise en perspective, le blog permet les commentaires.
Personne de sensé ne défendrait l’idée qu’il faille produire n’importe quel organisme muni de Gene-Drive et le libérer dans la nature. Pourtant …
Heidi Ledford mentionne en effet la légèreté avec laquelle certains ont produit des virus modifiés pour causer chez les souris un modèle du cancer du poumon. Imaginez une très légère erreur qui permettrait le développement du virus chez l’homme – lui causant un cancer !
But Doudna has begun to have more serious concerns about safety. Her worries began at a meeting in 2014, when she saw a postdoc present work in which a virus was engineered to carry the CRISPR components into mice. The mice breathed in the virus, allowing the CRISPR system to engineer mutations and create a model for human lung cancer4. Doudna got a chill; a minor mistake in the design of the guide RNA could result in a CRISPR that worked in human lungs as well. “It seemed incredibly scary that you might have students who were working with such a thing,” she says. “It’s important for people to appreciate what this technology can do.”
De nombreux scientifiques ont estimé important de prendre le temps de réfléchir.
Des scientifiques concernés se réunissent pour discuter de l’opportunité de déployer Gene-drive et des régulations à prévoir
Aux US la National Academy of Sciences a convoqué une conférence pour discuter de ces Gene-drive, et ont produit une série de guidelines.
Cela rappelle un peu la fameuse conférence d’Asilomar (1975) où les scientifiques s’étaient réunis pour discuter des potentiels énormes que leurs recherches sur la modification génique avaient ouverts et des mesures de prudence ou de retenue à adopter (moratoire). Première manifestation de la bioéthique ?
Le prof. Alex Mauron précise que « quand Hank Greely affirme qu’Asilomar est un exemple du succès et de la pertinence de la bioéthique, c’est une contre-vérité. Loin d’avoir un lien quelconque avec la bioéthique, Asilomar était au contraire un exemple d’autorégulation par les scientifiques à une époque où la bioéthique existait à peine. » Pr Alex Mauron iEH2 (Institut Ethique Histoire Humanités)
Ces scientifiques responsables et discutant de l’autorégulation ne correspondent pas à l’image que certains médias donnent des chercheurs … souvent dépeints comme assoiffés de gloire et indifférentes aux effets de leurs recherches ( science sans conscience …)-
En fait bien avant que les médias s’emparent de Gene-Drive pour en faire un sujet sensationnaliste, de nombreux scientifiques réfléchissent et envisagent de se modérer. C’est une question qui est vive parmi les scientifiques, pas encore parmi les médias. Il est temps qu’elle devienne une question vive à l’école ?
Sources :
- Cyranoski, D. (2015). Super-muscly pigs created by small genetic tweak. Nature News, 523(7558), 13. http://doi.org/10.1038/523013a
- Cyranoski, D., & Reardon, S. (2015). Embryo editing sparks epic debate. Nature, 520(7549), 593‑595. http://doi.org/10.1038/520593a
- Dolei, A., Uleri, E., Ibba, G., Caocci, M., Piu, C., & Serra, C. (2015). The aliens inside human DNA: HERV-W/MSRV/syncytin-1 endogenous retroviruses and neurodegeneration. The Journal of Infection in Developing Countries, 9(06), 577‑587. http://doi.org/10.3855/jidc.6916
- Gantz, V. M., & Bier, E. (2015). The mutagenic chain reaction: A method for converting heterozygous to homozygous mutations. Science, 348(6233), 442‑444. http://doi.org/10.1126/science.aaa5945
- Oye, K. A., Esvelt, K., Appleton, E., Catteruccia, F., Church, G., Kuiken, T., … Collins, J. P. (2014). Regulating gene drives. Science, 345(6197), 626‑628. http://doi.org/10.1126/science.1254287
- Editorial, Nature (2015). Driving test. Nature, 524(7563), 5‑5. http://doi.org/10.1038/524005b
- Ledford, H. (2015). Caution urged over editing DNA in wildlife (intentionally or not). Nature News, 524(7563), 16. http://doi.org/10.1038/524016a
- Ledford, Heidi CRISPR, the disruptor Nature News03 June 2015, 522, 20–24
- Liang, P., Xu, Y., Zhang, X., Ding, C., Huang, R., Zhang, Z., … Huang, J. (2015). CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes. Protein & Cell, 6(5), 363‑372. doi: 10.1007/s13238-015-0153-5
