Application de la loi de Hess par calorimétrie
1. But de l’expérience
Appliquer la loi de Hess pour déterminer la chaleur d’hydratation de l’acétate de sodium.
Illustrer avec un dispositif expérimental très simple une mesure calorimétrique avec un calorimètre quasi-adiabatique.
2. Introduction
Dans la présente expérience, nous allons appliquer la loi de Hess qui dit que la chaleur associée à une transformation qui est une combinaison de deux ou plus réactions élémentaires est égale à la somme des chaleurs associées aux réactions individuelles.
Par exemple, on connait les chaleurs associées aux réactions :
A –> B (1) et B –> C (2)
Alors, la chaleur associée à la réaction A –> C (3) est simplement la somme des chaleurs des réactions (1) et (2).
De même, si l’on connait les chaleurs des réactions :
A –> B (4) et A –> C (5)
la chaleur de la réaction B –> C (6) est donnée par la chaleur de la réaction (5) moins la chaleur de la réaction (4).
La loi de Hess est souvent utilisée pour calculer des chaleurs de réaction qui ne peuvent pas être mesurées directement.
Dans la présente expérience, on applique la loi de Hess pour déterminer la chaleur de la réaction d’ hydratation :
NaC2H3O2 (s) + H2O –> NaC2H3O2.3H2O (s)
à partir des chaleurs de dissolution de NaC2H3O2 (s) et de NaC2H3O2.3H2O (s).
3. Partie expérimentale
Sécurité : le port des lunettes est obligatoire durant la manipulation.
Matériel :
Calorimètre quasi-adiabatique [dewar,(thermos, gobelet sagex) couvercle, thermomètre (10-50 °C)].
NaC2H3O2 et NaC2H3O2.3H2O, cylindre gradué 100ml, bécher 100ml.
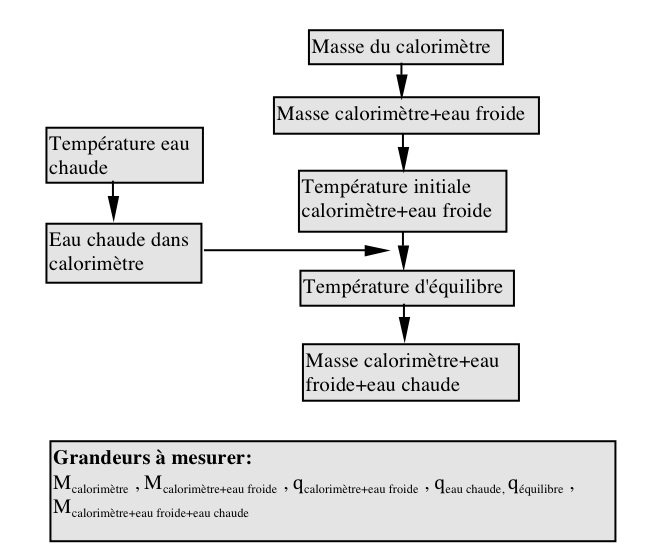
A. Détermination de la constante du calorimètre.
Mesurer environ 50 ml d’eau distillée à 0,1 ml près et mettre à chauffer dans un bécher de 100 ou 150 ml. Il ne faut pas faire bouillir l’eau, mais la chauffer au dessus de 90 °C.
Pendant que l’eau chauffe, mesurer environ 40 ml d’eau distillée et mettre dans le calorimètre. (N.B. le volume d’eau froide devrait être au moins de 5 ml inférieur au volume d’eau chaude.). Mesurer le plus précisément possible la température dans le calorimètre.
Lorsque l’eau chaude arrive presque à ébullition (au dessus de 90 °C), mesurer sa température et transférer rapidement toute l’eau chaude dans le calorimètre. Suivre la température du contenu du calorimètre et mesurer le plus précisement possible la température maximale atteinte. Lorsque la température commence à descendre, vider et sécher le calorimètre et recommencer avec un deuxième échantillon d’eau chaude et froide.
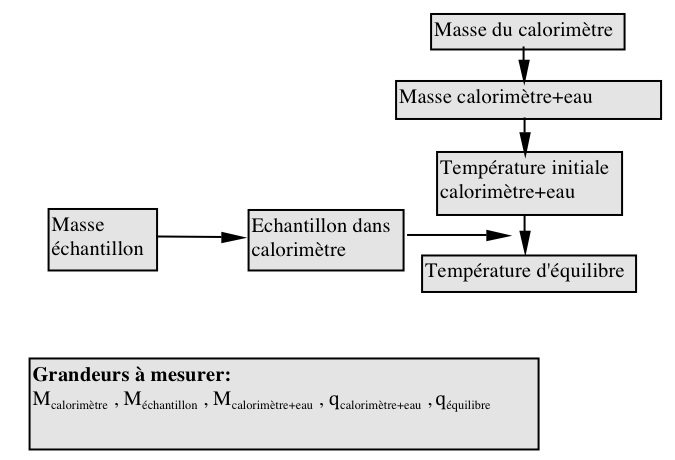
B. Détermination des chaleurs de dissolution de l’acétate de sodium anhydre et de l’acétate de sodium hydraté.
Vérifier que le calorimètre soit bien sec. Mesurer précisément 50 à 60 ml d’eau distillée et verser dans le calorimètre. Laisser reposer quelques minutes pour obtenir une température stable. Peser précisément environ 4g d’acétate de sodium anhydre dans un petit flacon ou sur un papier.
Lorsque l’eau dans le calorimètre a atteint une température constante, mesurer celle-ci au dixième degré près (ou plus précis). Ajouter tout le sel dans l’eau en veillant à ce qu’il n’y ait pas de poudre aux parois au dessus du niveau d’eau. Couvrir le calorimètre et agiter doucement le calorimètre pour faciliter la dissolution. Suivre l’évolution de la température et déterminer la différence maximale de la température avant et après adjonction du sel. (N.B. cette différence peut être positive ou négative.) La différence maximale de la température peut être atteinte après 5 minutes ou davantage.
Après la mesure, vider, rincer et sécher le calorimètre et répéter la procédure une fois.
Avec vos résultats, calculer la chaleur de dissolution de l’acétate de sodium anhydre.
Répéter la procédure en utilisant maintenant environ 6,6g d’acétate de sodium trihydraté.
Refaire cette manipulation une seconde fois et calculer la chaleur de dissolution de l’acétate de sodium trihydraté et finalement la chaleur d’hydratation de l’acétate de sodium anhydre pour former l’acétate de sodium trihydraté.
4. Calculs
A. Détermination de la constante du calorimètre K
La masse de l’eau pour chaque échantillon est obtenue à partir du volume mesuré et de la densité à la température initiale. La chaleur perdue par l’eau chaude est gagnée par l’eau froide et le calorimètre :
-qchaud = qfroid + qcalorimètre
ou bien – (m c ΔT)chaud = (m c ΔT)froid + (K ΔTcal) avec c = 4,184 [J/(g.deg)]
Note: ΔT = T(final) – T(initial) peut être positif ou négatif.
B. Détermination de la chaleur de dissolution:
qsolide = -(qeau + qcal.) = – (meau ceau ΔTeau + KΔTcal.)
La chaleur de dissolution ainsi obtenue est finalement convertie en chaleur molaire de dissolution. Les chaleurs molaires ainsi obtenues sont combinées pour obtenir la chaleur molaire d’hydratation de l’acétate de sodium.
Application de la loi de Loi de Hess par calorimétrie
A) Détermination de la capacité calorifique du calorimètre K (à faire 2 fois)
B) Détermination de la chaleur de dissolution de l’acétate de sodium anhydre et de l’acétate de sodium hydraté.
H. Hagemann, Dept. de Chimie Phyisque, Université de Genève
Ce qui s’est passé avec la classe avant, durant et après :des éclairage dans le plan des Savoirs en classe.
- Une classe a brûlé du chocolat : quelle énergie !
- Qu’en pensent-ils ? L’avis des élèves et du maître de physique
Ce que ces données pourraient vouloir dire est discuté dans un petit article qui discute comment la digestion détermine les calories effectivement absorbées : Un éclairage « Perspective sur les savoirs».
Le concept d’énergie a des sens très différents pour les élèves dans le contexte de l’alimentation et de la physique notamment pour le feu. L’énergie des aliments et l’énergie du feu est-elle la même ? Un éclairage « Perspective sur les savoirs »
Les méthodes de mesure et le contexte théorique qui fonde la mesure sont décrits icidans un article du Dr. Hans Hagemann. Éclairage Savoirs en science
Les élèves sont repartis avec des données de température en fonction du temps qu’ils ont produites eux-mêmes : AuthenTIC.
- AuthenTIC : des données résultant de mesures effectuées avec Expériment@l
- Les données des mesures faites par Juan Carlos Fallas sont disponibles pour les membres Expériment@l ici.xlsx
